文|動脈網
成功的商業故事,自然令人欣喜。但其實,盛極而衰的事件背后的邏輯,更值得回味。
相比傳統制藥,微生物制藥從早期開發、臨床試驗到商業化應用,整個過程都差異很大。一直以來,腸道微生物都被作為部分疾病后期解決方案中的一種。此前,FDA曾根據一項獨特的“執行自由裁量權”政策,允許糞菌移植(FMT)在未經批準的情況下進行。
轉折出現在2012年,FDA設立了一個新的產品類別,即活性生物治療產品(LBP),用于微生物藥物審批。由此點燃了微生物藥物的開發和投資熱潮。2022年,全球首款微生物藥物獲批上市。到2023年末,全球已經有3款微生物藥物獲批上市。
不過,明星藥企的大潰退,也出現在行業曙光剛剛亮起的2022年前后。裁員、退市、合作的管線被退回,甚至直接解散團隊。菌群制藥的前景,似乎烏云密布。在本文中,我們嘗試找到最容易擊垮微生物制藥企業的風險點,讓仍然奮戰在微生物藥物開發一線的企業,盡可能繞開。
沒有試錯空間

如果時光一定要往回倒,微生物制藥領域明星企業的這種潰退跡象,早在2019年就開始出現。在全球資本大舉入局的2019年,微生態制藥明星企業Seres Therapeutics解雇了30%的員工,重新聚焦核心管線的臨床推進。后來,隨著越來越多的管線進入臨床試驗的中后期,微生物制藥企業的經營風險也更大。
實際上,簡單梳理困境之中的微生物藥企過去幾年的研發投入和臨床成績會發現,臨床試驗難以推進的背后,原因往往十分唏噓。
一方面,作為開發創新生物技術的初創企業,微生物制藥企業在臨床試驗策略上缺少經驗,需要相對寬松的試錯空間,用失敗來換成功的可能。11月末剛剛全員解散的Evelo Biosciences是典型的反面案例。在外界的解讀中,幾條自研核心管線EDP1867、EDP1815、EDP2393的臨床試驗陸續失敗,Evelo難以為繼,只能解散。但其實,一直到最后,EDP1815都保持了治療銀屑病優異的安全性、有效性數據,EDP2393的長期數據也打敗了對照組。從某種意義上講,Evelo錯在了把有限的流動性給到錯誤的適應癥。
11月20日,Evelo董事會向美國證券交易委員會提交了其注銷計劃,結束了近10年的經營。2014年,在Flagship Pioneering的孵化下,Evelo正式成立,專注于開發治療免疫疾病的口服微生態藥物,用單一微生物菌株構成的藥物制劑,來上調或下調免疫途徑的功能。2018年,Evelo登陸納斯達克市場,募得8500萬美元資金,市值一度達到20億美元。在此之前,梅奧診所、GV、Celgene等一眾頂級機構和企業參與投資,Evelo成為相當亮眼的微生物制藥明星企業。
最先被Evelo放棄的,是EDP1867。2022年4月,EDP1867用于治療特應性皮炎的Ⅰ期臨床試驗宣告失敗。在接受低劑量藥物EDP1867的15名患者中,8周后沒有明確證據顯示該藥物有益處,EDP1867被擱置。
當Evelo集中力量開發EDP1815和EDP2393時,策略逐漸走偏。外界對于EDP1815最廣泛的認知,是治療特應性皮炎的有效性不及安慰劑。今年2月,EDP1815用于特應性皮炎的Ⅱ期臨床試驗,未能達到主要終點。根據試驗結果,對照組(安慰劑組)的EASI-50(即特應性皮炎病情評分改善50%)為56%,而EDP1815組在隊列1、2和3中,僅有分別41%、38%和32%的患者在第16周實現EASI-50及以上應答,有效性都不及安慰劑。
在當時,Evelo判斷問題出現在,安慰劑過于有效。遺憾的是,經過重新審查,在2023年4月公布的臨床試驗數據中,EDP1815的表現仍不敵安慰劑。在隊列4中,有37.9%的EDP1815組患者在第16周實現了EASI-50及以上應答,而安慰劑組為44.7%。
有意思的是,EDP1815在更早前的銀屑病II期試驗中,已經有了不俗的表現。按照Evelo的計劃,他們會推進EDP1815的開發,以廣泛治療選擇很少的輕度和中度疾病的銀屑病患者。但不知為何,Evelo并沒有集中火力做EDP1815治療銀屑病的III期臨床試驗。在銀屑病方面,Evelo押注的實際上是EDP2393。今年3月,Evelo曾收到納斯達克的退市警告。當時Evelo的CEO Simba Gill 博士表示,將把資源集中到基于其下一代細胞外囊泡平臺的首個候選藥物EDP2939項目上來。
遺憾的是,10月出爐的EDP2939治療銀屑病的Ⅱ期臨床試驗數據,仍然不理想。該研究的主要終點,即在每日治療16周后,EDP2939和安慰劑之間的銀屑病面積和嚴重程度指數(PASI)評分(PASI-50反應)較基線改善 50%的患者比例差異未實現。但值得注意的是,該數字比例從第16周時低于安慰劑(EDP2939組19.6% vs 安慰劑組25%)到第20周隨訪時優于安慰劑組(EDP2939組 33.9% vs 安慰劑組26.9%)。換言之,如果方案設計合理,EDP2939的臨床試驗失敗,或許可以避免。
這時,Evelo又嘗試調轉車頭,準備放棄EDP2939,重拾EDP1815。Simba Gill博士表示,“雖然我們對EDP2939的II期研究結果感到失望,但我們仍然相信我們的小腸軸(SINTAX)平臺的價值以及我們的潛在產品EDP1815。我們之前在一項針對輕度至中度銀屑病伴EDP1815的2期研究中報告了積極的療效和安全性數據。鑒于這項研究的結果,我們將停止開發EDP2939,并正在審查潛在的戰略替代方案,包括尋求與EDP1815和SINTAX平臺合作。“
在創新藥投融資鼎盛時期,只要臨床價值有足夠的數據支撐,策略的失敗并不足以致命。如今的臨床試驗,卻多少有點孤注一擲的意味。此前,Evelo嘗試用裁員的方式,來緩解資金壓力。2023年1月,Evelo裁員比例達45%,第二季度進一步裁員。但對于創新藥企而言,節流屬于遠水救不了近火。
外部資金枯竭
另一方面,在資金需求最大的臨床試驗階段,兩條可能的外部融資渠道,同時收緊,讓微生物制藥企業一時間失去了試錯機會。股權融資方面,流向生物科技的資金總量明顯縮水。BioWorld數據顯示,2020年以來,全球創新藥領域的投融資迅速降溫。從融資總額看,2022年全球創新藥企業共吸納608億美元融資,相比2020年高位時的1345億美元,只剩不到一半。與此同時,2023年上半年,二級市場的XBI指數在標普500指數上漲15.9%期間,逆勢下跌。在這個過程中,包括微生物制藥企業在內的大量生物科技初創公司都收到了退市警告。
2022年6月,另一家微生物制藥的明星企業4D pharma從納斯達克股票市場退市。從公開資料看,4D pharma并沒有重大過失,在研產品的臨床試驗也順利推進,除了融資困難,很難找到其他衰退原因。4D pharma是活體生物治療藥物開發領域的全球領導者,同樣原則基于口服給藥的單一細菌菌株來治療各種疾病。
資料顯示,4D pharma同時鋪開了6個臨床項目,分別是MRx0518聯合可瑞達?(帕博利珠單抗)治療實體瘤的I/II期研究、MRx0518聯合BAVENCIO?(avelumab)治療尿路上皮癌一線維持治療的II期臨床試驗、MRx0518在實體瘤患者新輔助治療中的I期研究、MRx0518治療胰腺癌患者的I期研究、MRx-4DP0004治療哮喘的I/II期研究,現金流壓力可見一斑。
其中,就在退市3個月前的2022年3月,該公司基于微生物組的在研療法MRx0518與抗PD-1抗體Keytruda聯用,在治療腎細胞癌的1/2期臨床試驗中達到主要療效終點。但是在投資者決策閾值提高了許多的當下,這樣的臨床進展,儼然很難吸引到足夠的外部資金。
對于生物科技初創企業而言,權限授權無疑是重要的資金來源。微生物制藥的早期興起,也離不開跨國藥企的重金布局。不過,近年來,跨國藥企對于微生物制藥的熱情,已經明顯衰減。據stifel統計,2023年,全球管線授權市場保持了與上年幾乎一致的并購節奏,但位列前三的適應癥中,微生物制藥企業重點布局的皮膚、胃腸系統疾病,并不在其列。
實際上,跨國藥企關于微生物制藥的態度,不但不再激進,反而開始撤退。2022年8月,在充分審視自身產品策略后,武田制藥決定解除與Finch Therapeutics在FIN-524和FIN-525之上的合作。隨后不久,Finch也終止了核心產品CP101的III期臨床試驗,持續經營風險顯現。
2022年8月,在開始裁員3個月后,Kaleido沒能找到合適的交易機會,停止了所有研發,這家由Flagship的微生物制藥企業,進入破產階段。然而,就在大半年以前,Kaleido的首席執行官Daniel Menichella還向媒體透露,將有望在2022年上半年開始潰瘍性結腸炎的II期研究。
Kaleido成立于2017年,由Flagship出資6500萬美元,并于2019年上市。該公司已與強生的楊森(Janssen)和MD安德森癌癥中心(MD Anderson Cancer Center)簽署了合作協議。2022年1月,Kaleido曾被曝裁員,隨后暫停了KB109的II期臨床試驗。但就在這個消息發布前幾周,強生旗下楊森生物技術公司擴大了與Kaleido的研究合作,以尋求特應性、免疫和代謝疾病的治療。
失去了寬松的外部資金環境,一款新藥商業化的難度,無疑大了許多。
微生物新藥走完了商業化的閉環
當然,拋開臨床開發的困境,微生物藥物的市場需求明確。
2023年4月,Seres Therapeutics的SER-109獲批上市,商品名VOWST,用于治療復發性的艱難梭菌感染。VOWST是全球第一款做成口服制劑的微生物藥物,含有一種被稱為厚壁菌門的有益腸道細菌,它的商業化將由Seres和雀巢共同完成,雙方將平分VOWST的銷售收入。
作為一款臨床新藥,VOWST一上市就取得了亮眼的市場反饋。根據Seres公布的最新財報,VOWST獲批后,自2023年6月開始在美國上市,到9月末,已經收到610份填寫完整的處方登記表。其中,有282名患者已開始接受VOWST的治療。此外,VOWST暫時還沒有納入商業保險,這些處方登記表由480多家不同的醫療保健提供者提交,有78名醫療保健提供者已經已向超過一名患者開出VOWST。
值得注意的是,VOWST的定價并不低,并且除了VOWST外,臨床上用于艱難梭菌治療,還有其他方案。艱難梭菌是一種常見于健康腸道微生物群中的細菌。當某人服用抗生素時,可能會改變腸道微生物的平衡,并導致危及生命的艱難梭菌感染(CDI)。即使它們被清除,由于腸道菌群不平衡,感染也可能多次復發。
目前,臨床上最常見的艱難梭菌感染治療方案是糞菌移植,但這種治療方式的體驗感非常差,人們一直嘗試開發新的治療方案。除了VOWST外,生物制劑貝羅妥昔單抗、灌腸劑REBYOTA都是近年出現的新療法。其中,REBYOTA在2022年上市,是全球第二款獲批的微生物藥物,它也需要從健康捐贈者身上采集腸道微生物樣本,與傳統的糞便微生物移植不同之處在于,REBYOTA的制備過程中涉及嚴格的指控流程,來確保微生物治療的穩定性。
現階段,由于上市時長都不長,還沒有直接將VOWST與上述替代方案進行比較的研究數據。但從數據的交叉對比看,VOWST的有效性在REBYOTA和貝羅妥昔單抗之上,在糞菌移植之下,治療成本是4類方案中最高,但用藥途徑最為友好。相對較好的療效和便捷的口服劑型,或許正是VOWST大受歡迎的原因。
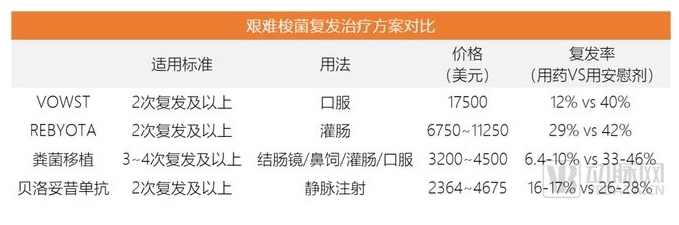
復發性艱難梭菌感染的治療方案對比,數據來源:動脈網根據公開資料整理
在這份財報中,Seres也承認,VOWST是一款很棒的產品,但由于價格非常高,商業化前景不明朗。從控費的角度看,商業保險計劃可能僅將VOWST作為第二線方案,即在更便宜的替代方案失敗后使用。如果不考慮價格因素,VOWST很容易成為醫生和患者預防復發性艱難梭菌感染的首選第一線選擇。當然,Seres也在嘗試降低VOWST的商業化使用成本。2023年8月,Seres關閉了3處捐獻者采集中心中的一個,并設立捐獻者篩選實驗室,來降低成本。
從某種意義上講,過去10年間,上百場臨床試驗下來,微生物制藥快速驗證了臨床價值。眼下,微生物制藥被卡在了商業價值之上。當近一半的海外微生物制藥明星企業相繼倒下,人們不禁為這個行業捏把汗。但顆粒度更細的觀察結果,是這個行業仍有下蹲再起跳的機會。我們仍然希望看到,當試錯空間和資金環境變得適當寬松后,可有更多的微生物新藥來解決復雜的臨床難題。



